Генетические технологии в современном рыбоводстве
Генетические технологии в современном рыбоводстве
Аннотация
Генетические технологии революционизируют аквакультуру XXI века. Этот обзор охватывает основные подходы к генетическому совершенствованию рыб: отбор по хозяйственным признакам, молекулярно-генетические методы, редактирование генома CRISPR/Cas9 и репродуктивные биотехнологии. Особое внимание уделено геномной селекции на основе SNP-маркеров, картированию QTL и криоконсервации половых клеток. Рассмотрены перспективы комплексной интеграции этих технологий для устойчивого развития аквакультуры.
Оглавление
Введение
Аквакультура обеспечивает половину мирового потребления рыбы и требует инновационных подходов к повышению продуктивности. Генетические технологии позволяют ускорить развитие пород рыб с улучшенными характеристиками: повышенным темпом роста, резистентностью к заболеваниям, оптимизированным составом питательных веществ и адаптивностью к стрессовым условиям.
Современная парадигма генетического совершенствования рыб интегрирует количественную генетику, молекулярную биологию и биотехнологические инструменты. Это позволило повысить генетический прирост с 3-4% при традиционном отборе до 15% при редактировании генома.
Отбор по хозяйственным признакам
Хозяйственные признаки (темп роста, конверсия корма, устойчивость к болезням) контролируются множеством генов и факторами окружающей среды. Коэффициент наследуемости (h²) определяет долю вариабельности, обусловленную генетикой: для роста h² = 0,3--0,5, для болезнеустойчивости h² = 0,1-0,3.
Генетический прогресс рассчитывается по формуле:
где i -- интенсивность отбора, h² -- наследуемость, ie - эффективность отбора.
Эффективные программы разведения рыб используют несколько подходов:
Семейно-ориентированный отбор - оценка особей в контексте их семей (полнородные и полусородные сибсы). Этот метод повышает точность оценки генетической ценности, особенно для низконаследуемых признаков.
BLUP-анализ (Best Linear Unbiased Prediction) - статистический метод оценки племенной ценности (EBVs), учитывающий полную генеалогическую информацию. BLUP увеличивает точность отбора на 15-25% по сравнению с массовым отбором.
Контроль инбридинга - поддержание генетического разнообразия путем ограничения коэффициента инбридинга (F < 0,1 за поколение) предотвращает депрессию инбридинга. Эффективная численность популяции (Ne) должна составлять не менее 50-100 особей.
Программы отбора в атлантическом лососе достигают ежегодного генетического прироста 4-6% по темпу роста. Китайские программы разведения тилапии увеличили массу тела на 130% за восемь поколений.
Молекулярно-генетические маркеры
Выделяют следующие типы маркеров:
Микросателлиты (SSRs) - тандемные повторы 2-6 базовых пар. Обладают высоким полиморфизмом и используются для анализа генетической структуры популяций и определения родства (ДНК-фингерпринтинг).
SNP-маркеры (однонуклеотидный полиморфизм) - наиболее распространенный вариант ДНК. Генотипируются кодоминантно, позволяя создавать высокоплотностные маркерные карты. Современные SNP-панели содержат от 1000 до 50 000 маркеров.
AFLP (амплифицированные полиморфные фрагменты длины) - метод, генерирующий сотни маркеров из рестрицированной ДНК. Эффективен для видов с неполной информацией о геноме.
Импутация генотипов позволяет восстановить полные генотипы из низкоплотностных панелей, используя данные о неравновесии по сцеплению (LD). Это снижает стоимость генотипирования на 70-80%, сохраняя точность предсказания.
Картирование локусов количественных признаков (QTL) выявляет хромосомные регионы, контролирующие хозяйственные признаки. Процесс включает построение генетической карты сцепления, фенотипирование линий и корреляционный анализ маркеров.
Геномная селекция
Геномная селекция использует предсказания племенной ценности на основе всех SNP-маркеров (GEBVs) вместо традиционных EBVs. Этот метод:
Сокращает поколенческий интервал - молодь генотипируется на ранней стадии, позволяя начать селекцию через несколько недель
Повышает точность отбора - особенно для признаков с низкой наследуемостью (точность возрастает на 25-35%)
Снижает инбридинг - на 81% по сравнению с традиционным отбором
Существуют два основных алгоритма предсказания:
GBLUP (genomic BLUP) - расширение классического BLUP с использованием матрицы геномного родства. Обеспечивает точность 0,82-0,89 при h² = 0,4-0,5.
Байесовские методы - используют вероятностные модели для оценки эффектов маркеров. Могут захватывать эффекты отдельных маркеров большого действия.
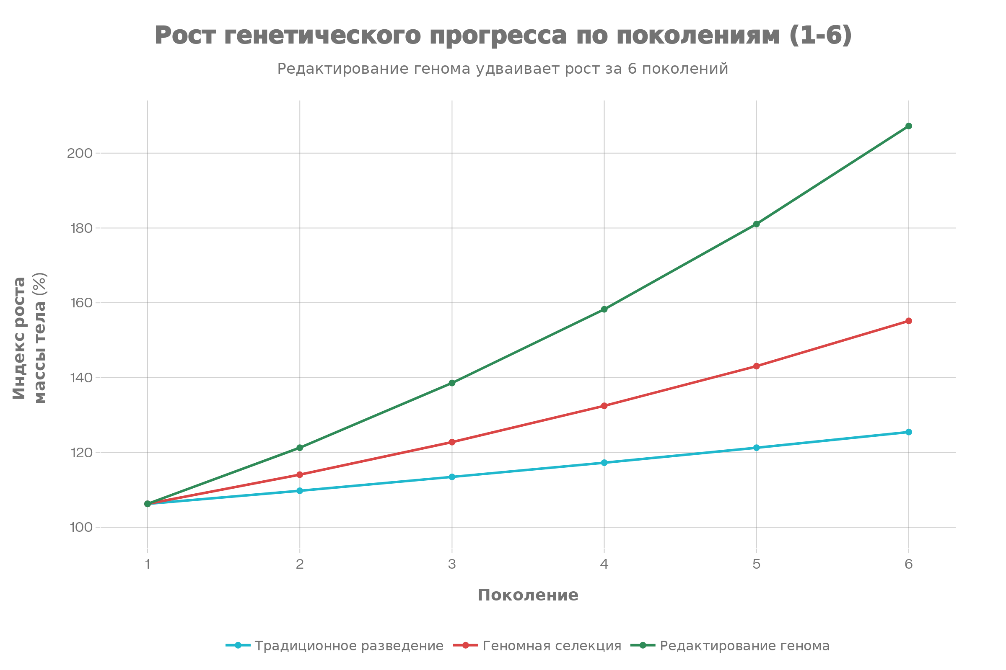
Данные показывают, что геномная селекция достигает генетического прироста 7,8% ежегодно, что в два раза выше традиционного отбора. На графике ниже представлен рост генетического прогресса по поколениям.

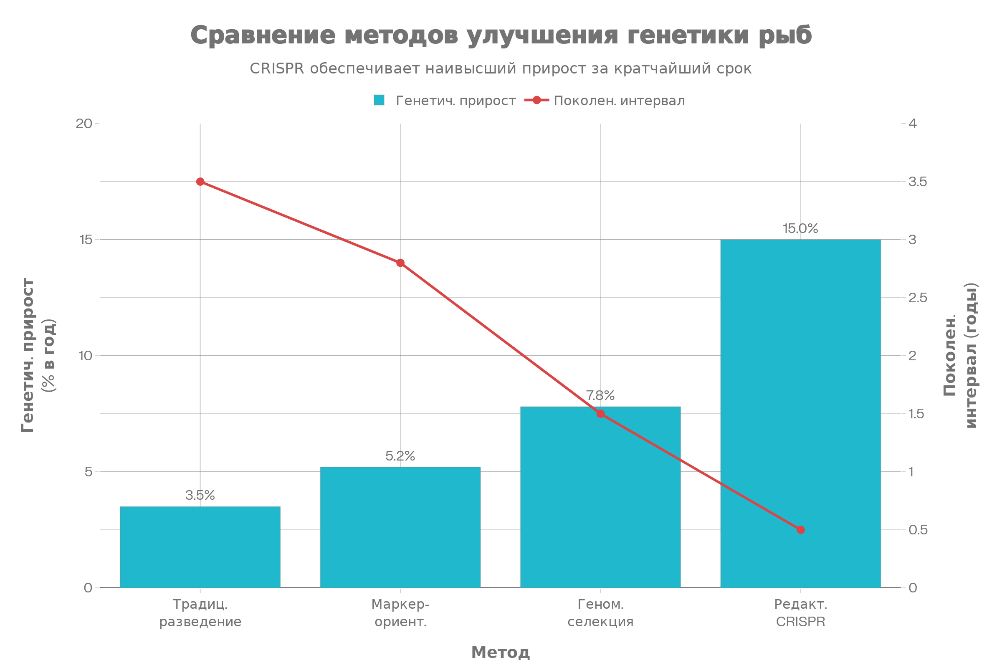
Сравнение различных подходов к улучшению рыб. На графике показано, что редактирование генома обеспечивает наибольший генетический прирост при минимальном поколенческом интервале.
Редактирование генома CRISPR/Cas9
Механизм действия CRISPR/Cas9. Так как это адаптивная иммунная система бактерий, преобразованная в инструмент редактирования генома, процесс включает четыре основных этапа, представленные на схеме ниже:
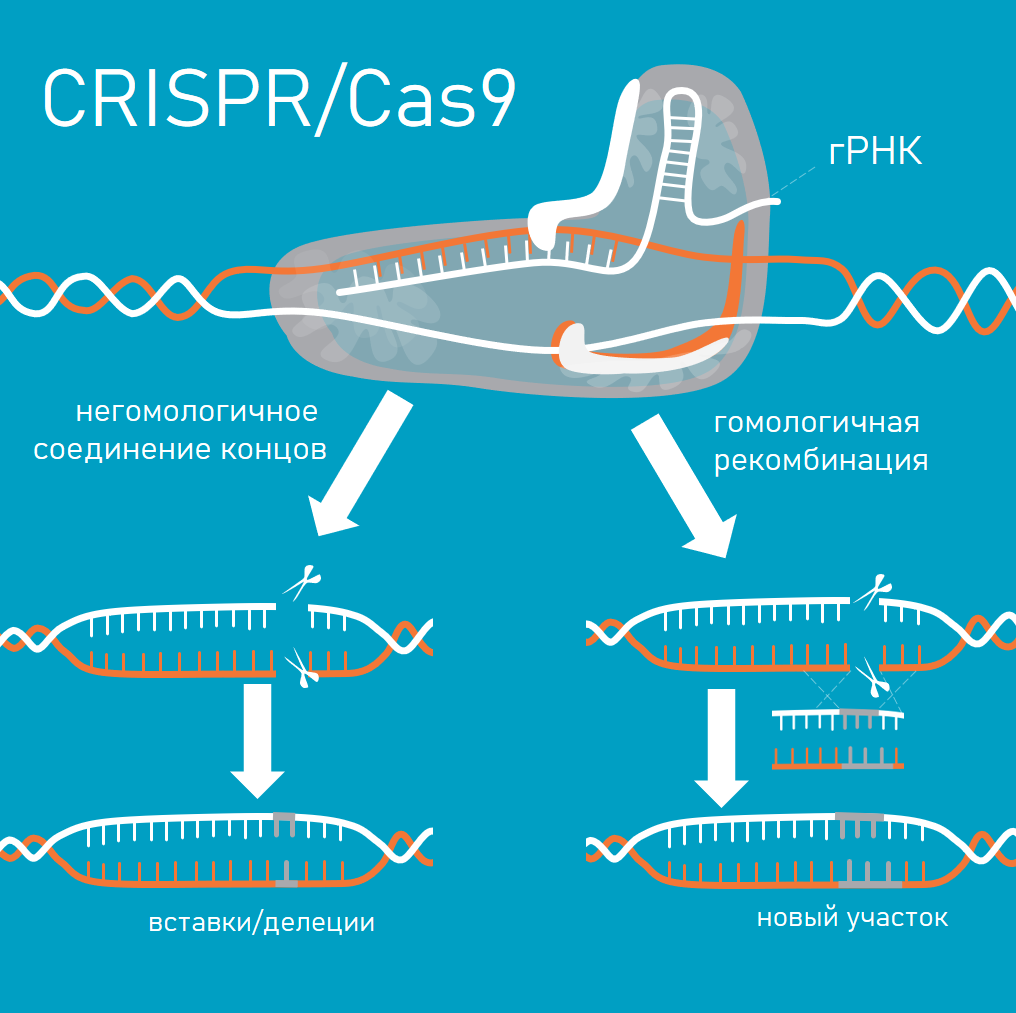
В рыбоводстве важны 4 основных аспекта:
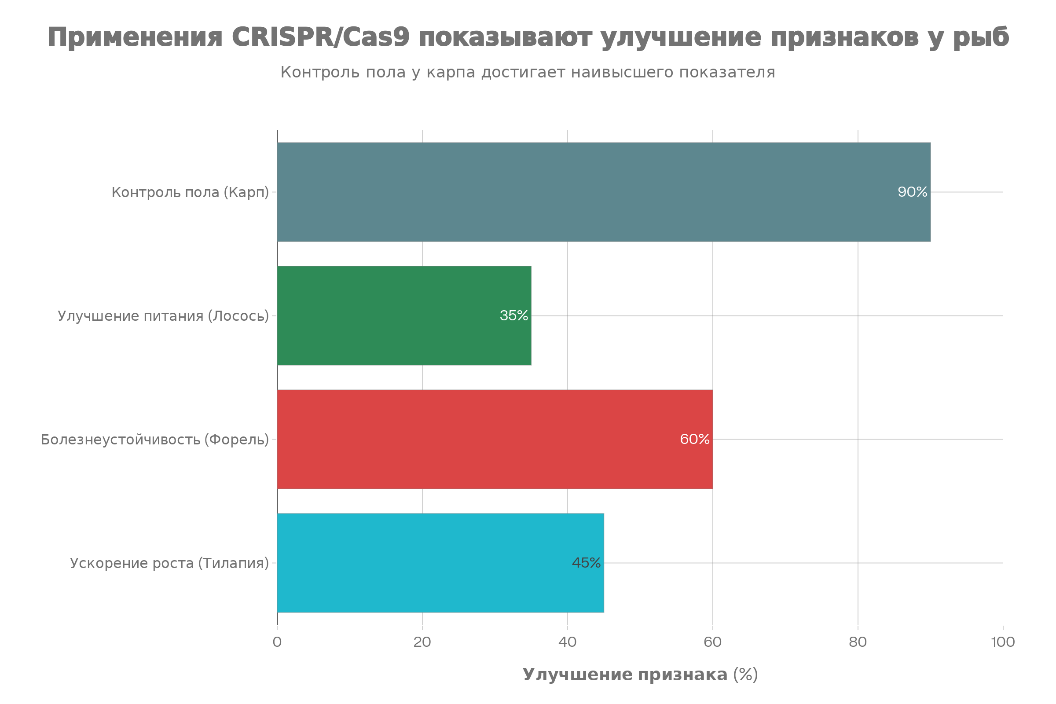
Ускорение роста - редактирование генов GH (гормон роста) и GHR (рецептор GH) в тилапии и лососе. Результаты: прирост массы на 45-50% за счет усиленной экспрессии ростовых факторов.
Болезнеустойчивость - редактирование генов Mx (устойчивость к вирусам) и TLR2 (распознавание бактериальных антигенов) в форели обеспечивает 60% улучшение выживаемости при инфекциях.
Питательный состав - модификация гена Elovl2 в лососе увеличивает содержание омега-3 полиненасыщенных жирных кислот (ПНЖК) на 35%, повышая функциональность продукта.
Контроль полового созревания - редактирование cyp19a1a (ароматаза) в карпе достигает 90% эффективности в создании стерильных особей.
AquAdvantage Salmon - коммерческий пример, содержащий трансген гормона роста. Рыба достигает товарного размера на 60% быстрее дикого типа.
Основные методы доставки генов - это микроинъекция в пронуклеус яйца, электропорация оплодотворённых яиц и липофекция (использование липидных везикул).
Эффективность редактирования генома CRISPR/Cas9 по различным признакам наглядно демонстрирует сравнительный анализ для разных видов рыб.
Репродуктивные биотехнологии
Искусственное оплодотворение (ИО) позволяет контролируемое скрещивание и увеличивает потомство от ценных особей. ИО широко применяется в программах разведения лосося, форели и сома, обеспечивая управление генотипом родителей и поддержание генетического разнообразия.
Криоконсервация половых клеток при -196°C в жидком азоте сохраняет сперматозоиды неопределённо долго. Полный процесс с ключевыми этапами, температурными режимами и показателями успеха представлен на иллюстрации ниже.
При оптимизации достигаются следующие показатели: жизнеспособность спермы после разморозки составляет более 80%, успешность оплодотворения превышает 85%, а выживаемость личинок - более 80%.
Криобанки позволяют сохранять генетическое разнообразие редких линий, обмениваться генетическим материалом между хозяйствами и снижать зависимость от живого маточного стада.
Также возможно использование одного вида как суррогата для гаметогенеза другого вида. Особенно ценно для видов с длительным поколенческим интервалом. Комбинация с CRISPR-редактированием позволяет получить отредактированные полнофункциональные гаметы.
Эпигенетические механизмы
Эпигенетика изучает наследуемые изменения экспрессии генов без изменения ДНК-последовательности. Метилирование ДНК представляет собой добавление метильных групп к цитозину в CpG-сайтах, при этом метилированные промоторы подавляют экспрессию генов. Модификации гистонов, такие как ацетилирование и метилирование гистонов H3 и H4, изменяют степень компактности хроматина. Некодирующие РНК, включая микроРНК и длинные некодирующие РНК, регулируют экспрессию генов на посттранскрипционном уровне.
Оценим влияние окружающей среды. Абиотические факторы вызывают эпигенетические модификации:
температура (изменения метилирования генов теплового шока и половой дифференцировки)
соленость (эпигенетическая регуляция осморегуляторных генов)
загрязнители (аномальное метилирование генов детоксификации)
питание (влияние микронутриентов на доступность метильных групп)
Исследования показали трансгенерационную наследуемость температурно-индуцированных эпигенетических изменений.
Интеграция технологий
Современные программы селекции интегрируют фенотипирование ядра селекционной популяции по 15-20 признакам, генотипирование с использованием низкоплотностных SNP-панелей (1000-2000 маркеров), импутацию до полного генотипа, оценку традиционных и геномных племенных ценностей (EBVs и GEBVs), отбор с учётом родословных и геномных данных, а также контроль инбридинга на уровне F < 0,1.
Интегрированный метод обладает превосходством перед другими. CRISPR редактирование достигает 201% от исходного уровня роста за 6 поколений, в то время как традиционный отбор - только 119%. Геномная селекция занимает промежуточное положение с 148%. Тогда CRISPR может дополнять селекцию, вводя критические аллели за одно-два поколения, что традиционный отбор требует 10-20 поколений.
Практические примеры
Атлантический лосось - программы отбора работают с 15-20 признаками одновременно. Геномная селекция сокращает поколенческий интервал с 3 лет до 1,5 лет, достигая генетического прироста 4-6% ежегодно.
Тилапия - китайская программа достигла 130% увеличения массы за 8 поколений. Редактирование GH-генов обеспечивает дополнительный 45% прирост.
Форель - редактирование Mx-гена повысило выживаемость при вирусных инфекциях на 60%.
Карп - редактирование dmrt1 создало полностью стерильные популяции (90% эффективность), предотвращая побеги.
Интеграция даёт ряд существенных преимуществ: обеспечивает ежегодный генетический прирост на уровне 10-15%, сокращает время создания новой линии с 10 до 2-3 лет, снижает затраты на производство за счёт повышения эффективности конверсии корма на 15-25%, а также повышает устойчивость к болезням и позволяет уменьшить использование антибиотиков. В то же время существуют и определённые угрозы, связанные с необходимостью сохранения генетического разнообразия при конвергентной селекции, предотвращением интрогрессии в дикие популяции в случае побегов, учётом нормативно-правовых ограничений на использование ГМО-рыб в разных регионах, а также необходимостью информировать общественность и обеспечивать принятие внедряемых инноваций.
Заключение
Генетические технологии - стратегический инструмент для создания устойчивой высокопродуктивной аквакультуры. Комплексная интеграция отбора по хозяйственным признакам, молекулярных маркеров, геномной селекции и редактирования генома обеспечивает беспрецедентные темпы генетического улучшения.
Современные подходы позволяют достичь генетического прироста 7-15% ежегодно при одновременном сокращении инбридинга и поколенческого интервала. CRISPR/Cas9 открывает возможности для целенаправленного внедрения улучшений, которые традиционная селекция требует десятилетий.
Успешная реализация потенциала этих технологий требует междисциплинарного сотрудничества, инвестиций в научные исследования, развития нормативно-правовых рамок и диалога с общественностью. Генетические технологии в рыбоводстве - ключ к продовольственной безопасности растущего населения при минимизации экологического ущерба.
Список источников
Жиганова, Л.П. - Применение генной инженерии CRISPR/Cas9 (CyberLeninka, 2023)
Fish-info.ru - Применение CRISPR/Cas9 для создания мутаций у сома (2025)
Официальный портал Федерального агентства по рыболовству (Росрыболовство) - Новость о развитии генетических технологий в аквакультуре (2025)
Russ Fish Expo - Материалы форума "Умная селекция: как генетика меняет аквакультуру России" (2025)
Zhou, L., et al. (2018). CRISPR/Cas9 Mediated Targeted Mutagenesis of GHR in Atlantic Salmon. Scientific Reports, 8, 12855.
Tudi, M., et al. (2021). Sustainable Use of CRISPR/Cas in Fish Aquaculture. Journal of Aquaculture Research and Development, 12, 674.